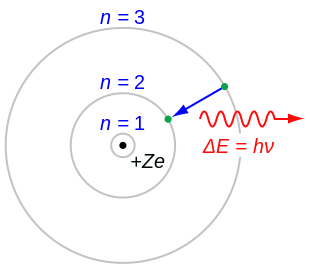
Nach dem Bohrschen Atommodell bewegen sich Elektronen auf Kreisbahnen bestimmter Energie. Hier wechselt ein einzelnes Elektron von der 3. auf die 2. Kreisbahn; es wird ein Photon entsprechender Frequenz ausgesendet. Die Atome bestehen aus einem positiv geladenen Atomkern und einer negativ geladenen Atomhülle. Jeder Atomkern enthält positiv geladene Protonen. Da Atome elektrisch neutral sind, muss die positive Ladung jedes Atomkerns durch eine entsprechende Menge negativer Elektrizität kompensiert werden. Dies geschieht dadurch, dass eine der Zahl der positiven Kernladungen numerisch gleiche Anzahl von Elektronen den Atomkern umgibt. Ein neutrales Atom kann aber zusätzlich Protonen aufnehmen. In diesem Fall überwiegt die positive Ladung. Solche Atome werden positive Ionen genannt. Aufgrund der chemischen Eigenschaften von Metallen bilden diese im natürlichen Zustand immer positiv geladene Kationen. Das Fehlen von Elektronen in den Orbitalen führt dabei zu veränderten chemischen Eigenschaften.
Jedes chemische Element ist durch eine ganz bestimmte Anzahl positiver Ladungen je Atomkern charakterisiert, nach heutigem Stand der Kenntnisse von 1 – 118, entsprechend 118 der bis jetzt bekannten verschiedenen Elementen. Die Elektronen der Elektronenhülle verteilen sich gesetzmäßig auf insgesamt 7 räumliche Schalen, die von innen nach außen mit den Buchstaben K bis Q des Alphabets als K-, L-, M-, O- Schale usw. bezeichnet werden. Die erste Schale (K-Schale) kann höchstens 2 Elektronen aufnehmen. Wenn mehr als zwei Elektronen vorhanden sind, müssen diese in die nächsten Schalen übergehen. Die L-Schale fasst höchstens 8, die M-Schale ebenfalls 8 (bzw. 18), die N-Schale 32 und die O-Schale 18 Elektronen. Wenn die äußere Schale komplett ist, sind die Atome gesättigt und zu keiner chemischen Reaktion mehr zu veranlassen. Dies ist der Fall bei den sog. Edelgasen Helium, Argon usw. Der einfachste Fall eines Atoms liegt dann vor, wenn ein einzelnes Elektron einem positiv geladenen Atomkern zugeordnet ist. Dies ist der Fall beim 1. Element des Periodensystems dem neutralen Wasserstoffatom (H), welches als Grundelement angesehen werden kann. Die Elektronen, die dem Atomkern am nächsten sind, die K- Elektronen, können vom Kern eingefangen werden, dies führt zu einer Elementumwandlung. Fast sämtliche schweren instabilen Kerne mit Protonenüberschuss wandeln sich durch Bahnelektroneneinfang in stabile Kerne um. Da die Elektronen der K-Schale die größte Aufenthaltswahrscheinlichkeit am Ort des Atomkerns haben, stammt das eingefangene Elektron in ca. 90 Prozent aller Elektroneneinfänge aus dieser Schale.

Beispiele für natürliche Elementumwandlungen. Die obere Zahl steht für die Massenzahl (Anzahl der Protonen und Neutronen). Die untere Zahl steht für die Anzahl der Protonen.
Die alchimistischen Verfahren sind auf eine durch Atomzerfall bewirkte Umwandlung eines Metalls in ein anderes gerichtet. So bedarf es zur Umwandlung von Quecksilber 80Hg zu Gold 79Au nur des Einfangs eines K-Elektrons.
